Lidia M. Yshii, Reinhard Hohlfeld and Roland S. Liblau
Inflammatory CNS disease caused
by immune checkpoint inhibitors:
status and perspectives
NATURE REVIEWS | NEUROLOGY ADVANCE ONLINE PUBLICATION | 1
NATURE REVIEWS | NEUROLOGY ADVANCE ONLINE PUBLICATION | 1
immune check therapies
- 近年、悪性腫瘍発症に関わる遺伝子mutationが明らかになってきた
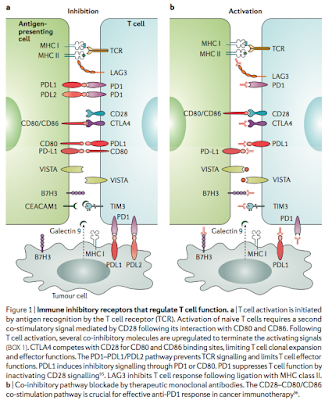
- MHC-抗原ペプチド複合体によってT細胞が活性化する
- T細胞に発現している共刺激分子受容体からのシグナルと、サイトカインによる刺激によって、T細胞の分化や増殖が起きる
- また、T細胞の活性化によって、co-inhibitor receptorも発現することによって、homeostasisを保つようになっている
- ICIによって自己免疫疾患様の病態が発症することが知られている
現在進行中のICI関連臨床試験
Target
|
Drug
name
|
Drug
type
|
mAb
isotype
|
Number
of clinical trials (as of September 2017)
|
CTLA-4
|
Ipilimumab
|
Human mAb
|
IgG1k
|
405
|
Tremelimumab
|
Human mAb
|
IgG2k
|
123
|
|
AGEN-1884
|
Human mAb
|
IgG1
|
1
|
|
PD-1
|
Pembrolizumab
|
Humanized mAb
|
IgG4k
|
594
|
Nivolumab
|
Human mAb
|
IgG4k
|
497
|
|
PDR001
|
Humanized mAb
|
IgG4
|
28
|
|
SHR1210
|
Humanized mAb
|
IgG4k
|
19
|
|
REGN2810
|
Human mAb
|
IgG4
|
13
|
|
Pidilizumab
|
Humanized mAb
|
IgG1k
|
5
|
|
AMP 514
|
Humanized mAb
|
IgG4k
|
4
|
|
BGB A317
|
Humanized mAb
|
IgG4
|
4
|
|
PF-06801591
|
mAb
|
–
|
2
|
|
AMP224
|
Fusion protein of
PD-L2 and Fc domain of human IgG
|
NA
|
2
|
|
PD-L1
|
Atezolizumab
|
Humanized mAb
|
IgG1k
|
183
|
Durvalumab
|
Human mAb
|
IgG1k
|
200
|
|
Avelumab
|
Human mAb
|
IgG1k
|
68
|
|
BMS 936559
|
Human mAb
|
IgG4
|
3
|
|
B7-H3
|
MGA-271
|
Humanized mAb
|
IgG1
|
5
|
MGD-009
|
B7-H3
x CD3 DART protein
|
NA
|
1
|
|
LAG-3
|
IMP-321
|
LAG-3 and human IgG1
fusion protein
|
NA
|
10
|
BMS-986016
|
mAb
|
–
|
9
|
|
LAG-525
|
Humanized mAb
|
IgG4
|
1
|
|
TIM-3
|
TSR-022
|
Humanized mAb
|
IgG4
|
1
|
MBG-453
|
mAb
|
–
|
2
|
|
VISTA
|
CA-170
|
Small-molecule
antagonist
|
NA
|
2
|
GITR
|
TRX-518
|
Humanized mAb
|
IgG1
|
2
|
INCAGN01876
|
Human mAb
|
IgG1
|
2
|
|
GWN-323
|
Human mAb
|
IgG1
|
1
|
|
MEDI1873
|
Human mAb
|
IgG1
|
1
|
|
MK-4166
|
Human mAb
|
IgG1
|
1
|
|
MK-1248
|
mAb
|
–
|
1
|
|
BMS986156
|
mAb
|
–
|
1
|
|
CD27
|
Varlilumab
|
Human
|
IgG1k
|
10
|
CD70
|
SGN-CD70A
|
mAb
|
–
|
1
|
CD40
|
ISF35
|
Adenovirus vector
|
NA
|
7
|
RO70097890
|
mAb
|
–
|
1
|
|
OX40
|
MEDI-6469
|
mAb
|
Murine IgG1
|
5
|
MOXR-0916
|
Humanized mAb
|
IgG1
|
3
|
|
PF-04518600
|
Human mAb
|
IgG2
|
4
|
|
MEDI-0562
|
Humanized mAb
|
IgG1
|
3
|
|
4-1BB
|
Urelumab
|
Human mAb
|
IgG4k
|
15
|
Utomilumab
|
Human mAb
|
IgG2
|
4
|
DART, Dual-Affinity Re-Targeting; mAb,
monoclonal antibody; NA, not applicable.
神経系irAE
- 多くはメラノーマに対するICIによって生じる
- CLTA4-抗体では1%、PD1抗体では3%程度の頻度(下垂体炎を除く)
- 併用療法では14%程度
- 典型的には最初の投与後4ヶ月以内に生じる
- 他のirAEと併発しやすいかどうかはわかっていない
- ギランバレー、CIDP、重症筋無力症、末梢神経障害など末梢神経系の報告もあるが、今回はCNS病変について述べていく
病態
- いくつかのシナリオがある
- 腫瘍随伴症候群が存在し、ICIによって腫瘍に対する免疫反応が増強した結果、CNSと交差反応を起こす
- ICIによって、腫瘍に対する免疫反応と、神経系に対する免疫反応と、それぞれ独立した免疫反応が増強される
- 例:転移性メラノーマに対するICI後に、radiologically isolated syndrome (RIS)がclinically definite MS (CDMS) へ移行する
- ICIがターゲットにしているCTLA4やPD1などが、神経組織の内皮細胞・アストロサイト・ニューロンなどに発現しており、補体介在性反応や細胞障害性反応などによって直接的に攻撃する
- 例:CTLA-4抗体による下垂体炎など
- 上記3つのいずれかによって生じたCNS inflammationは、ICIのin situでの反応によって増強されうる
- アストロサイト、ミクログリアでは、炎症状態ではPDL1が強く発現しているため、これをICIで阻害することで炎症が増強する
- これは、動物モデルで示されているように、MSの増悪 or 自己免疫性脳炎の発症 or 腫瘍随伴神経症候群の原因にもなる
paraneoplastic neurological syndromes and autoimmune encephalitis
- 腫瘍随伴神経症候群は、腫瘍に対する免疫反応が関与している
- Lambert-Eaton症候群は、腫瘍(主には小細胞肺がん)と神経筋接合部のvoltage-gated calcium channels が交差反応を起こしている
- 最近の研究で、動物モデルでは、CTLA-4抗体によってparaneoplastic cerebellar degenerationが 生じたことはこれを支持する
- ICIによって、自己免疫性脳炎が発症することもある
- 投与後数週間と早いものもあれば、7-12ヶ月後と遅いものもある
- 2つ、症例報告がある
- 1つは転移性メラノーマに対して、もう1つは小細胞肺がんに対して、nivolumab 1mg/kg + ipilimumab 3mg/kg を単回投与したところ、いずれも2週間以内に髄液中のリンパ球が増加した。転移性メラノーマの症例では髄液にてN-methyl-d-aspartate receptor (NMDAR)に対するIgG抗体が陽性となり、小細胞肺がんの症例では血清anti-glial nuclear antibodiesが陽性となった。いずれの症例も免疫抑制治療で神経症状は軽快。
- メラノーマでは異常なNMDARが発現している
- NMDAR subunit GluN2A をコードしている遺伝子が、メラノーマではしばしばmutationを有しており、ICIを投与することでこのmutationに対する免疫反応が惹起されることが想定される
- 小細胞肺がんでは、HuD、転写因子であるSOX2を発現しており、これらは神経系の抗原でもある
Multiple sclerosis
- MSモデルマウスでは、PD1阻害によって神経症状が増悪する
- これは、myelin-oligodendrocyte glycoprotein (MOG) 35–55 peptide に対するCD4陽性T細胞(多くはTh17)が増加することが関連するものと思われる
- ICI投与後にMS増悪 or 新規発症した、いくつかの症例報告もある
- 投与後数週間 or 数ヶ月以内に神経症状を呈する
- 転移性メラノーマに対してipilimumabを使用した後に、radiologically isolated syndrome (RIS)がclinically definite MS (CDMS) へ移行した症例あり
- この症例では、悪性腫瘍に対する治療を開始する前にMRIにてRISがあり、髄液にてオリゴクローナルバンドも陽性だった。そして、メラノーマに対してipilimumabを投与した。しかし、その4ヶ月後にCDMSを発症した。ipilimumabは2年間隔で2コース投与されたが、IFNβ治療によってMSは症状・画像的にも安定している。
- この症例からは、もし致死的な腫瘍の場合には、CNSの炎症性疾患があったとしても、それはICIの禁忌とはならないことを示している
- そして、この症例では、髄液を6ヶ月間隔で2回採取している。最初の髄液ではiplilimumab投与前に切除した腫瘍細胞の特異的な抗原に対する受容体を有するCD4陽性T細胞・CD8陽性T細胞のクローンが特定された。しかし、6ヶ月後に2回目に採取した髄液では、このT細胞のクローンは消失しており、他の抗原に対するクローンが出現していた。
- これは、ipilimumabが、それぞれ別の免疫反応を増強させたことを示している。最初のクローンは腫瘍に対する免疫反応であり、2回目の髄液にあるクローンはCNS組織(RIS)に対する免疫反応である。
- MSとメラノーマの間には分子相同性が明らかでないためICI誘発性の腫瘍随伴症候群とは言えず、いくつかのクローンT細胞は腫瘍と髄液の両者に存在していたため、ICIによって全身性に腫瘍に対する免疫反応が増強した結果、クローン細胞が一時的に髄液に漏れ出たのが原因かもしれない
- 上記より、腫瘍に対する免疫反応の低下と自己免疫の制御は似ているといえる
- これには、regulatory T細胞によるT cell exhaustionも含まれる
- ICIは、主に抗原をprimingするリンパ組織で機能しており、これはCNSの外である。
- 腫瘍は、PD1-PDL1の反応によって免疫から逃れている
- 上記症例の結果も考慮すると、MSも転移性メラノーマも、その病変がある部位以外の部位が強く関与していることが示唆される
- しかしながら、ICIは脳転移がある場合やBBBが破綻している場合ではCNSでも作用することもある
Hypophysitis
- 頭痛、倦怠感、記憶障害、ホルモン不足(ACTH and/or TSH)による症状などが生じる
- CTLA-4抗体(9-10%)のほうがPD1抗体(<1%)より頻度多い
- 他の神経irAEと異なり、併用療法で頻度は増加しない
- 悪性腫瘍の種類によっても頻度に差はない
- 発症頻度はipilmumabに関しては用量依存性に増加する傾向にある
- 投与開始6-12週に発症することが多い
- 特発性のように、女性に多いということもない
- MRIが脳転移との鑑別に有用(ステロイド開始前に撮影すれば、造影効果を伴うびまん性腫大)
- 高用量ステロイドが予後を改善するエビデンスはなく、ホルモン補充がしばしば必要になる
- 病理組織を検討した症例が1例のみあり
- 補体とともに、CTLA-4抗体が下垂体に沈着していた
- 個人差はあるが、CTLA4は下垂体内分泌細胞に強く発現していることがあり、これがCTLA4抗体の標的となっているのかもしれない
- 尿崩症を伴う場合は神経下垂体も障害されているが、神経下垂体には一般的にはCTLA4は発現していないのが、尿崩症の頻度が低いことの原因かもしれない
- しかしながら、下垂体にCTLA4が発現している細胞は全体の3%未満であり、直接的に細胞障害性にCTLA4抗体が障害していることが主要な病態とはいいにくい
- CD4陽性T細胞とB細胞が下垂体に著明に浸潤しており、自己免疫性の反応の可能性はある
- 他の研究で、ipilimumabを投与した20症例において、下垂体炎を発症した7例全例が下垂体内分泌細胞に対する自己抗体が陽性になっており、下垂体炎を発症しなかった症例はいずれも陰性だった
other neuroinflammatory disorders
- 視神経炎
- ipilimumab、pembrolizumab
- 横断性脊髄炎
- ipilimumab
- Relapsing acute tumefactive demyelinating inflammatory lesion
- ipilimumab、nivolumabで治療された転移性メラノーマの症例
clinical implications
- ipilimumabの場合は、治療開始前に、baselineのホルモン値(甲状腺、ACTH、cortisol、男性ならテストステロン)を測定しておくべきである
- この筆者らは、baselineの頭部MRIも撮影しておくべきと言っている
- その後は臨床症状、各投与サイクル前にホルモン値を測定
- 早期発見が重要
- 血液検査、髄液検査、MRIは脳転移、代謝性疾患、脳卒中、感染症、放射線治療による有害事象の除外のためにおこなう
- 腫瘍随伴症候群の一部では、脳実質のT細胞浸潤や組織破壊を伴う
- こういった状況ではICIによる治療が有効かもしれないが、腫瘍随伴神経症状 or 自己免疫性脳炎はICIによって増悪 or 新規発症する可能性があるので注意する
- そのため、小細胞肺がんなど腫瘍随伴症候群を伴いやすい悪性腫瘍の場合は、神経症状をより慎重にフォローし、ICI治療開始前・治療中に自己抗体の評価をしておく
- すでに腫瘍随伴神経症状がある場合には、ICIにはリスクが伴うので、開始するかは慎重に検討する
- 治療としては確立したものはない
- 重症であればICIを中止し免疫抑制治療を行う
- IVIg、B細胞除去治療、血漿交換が奏功した報告もあり
Future considering
- 腸内細菌と、ICIの有効性・有害事象との関連は研究中である
- もともとCNS inflammationがある場合に、ICIを開始してよいかに関しては、今後検討が必要である
- 上記の通りMSが増悪した症例や、そのCNS inflammationに対する治療を受けながらICIを投与した症例もあるので、実臨床ではリスクベネフィットを考慮していく
- もともとある自己免疫疾患に対して免疫抑制治療を受けながらPD1抗体を使用した場合に、腫瘍に対するICIの有効性が落ちたという報告もある
- アルツハイマー病に関しては、実験モデルでは炎症を抑えることで疾患の進行を抑制したという報告もあるが、PD1阻害によって海馬と大脳皮質のアミロイドβプラークのクリアランスが亢進し認知機能が改善したというマウスモデルの報告もある
- PD1阻害によってIFNγによる反応を惹起しマクロファージがCNSへ侵入しやすくなったのかもしれない。すなわち、神経変性疾患に対してもICIが治療選択肢となる可能性もある
- そして、脳転移や局所脳放射線治療が神経系irAEを引き起こすかは不明だが、そのような報告が相次いでいる
- 然しながら、神経系を含むirAEが腫瘍に対する有効性を予測するという報告もあり、irAEの腫瘍反応性に対するpositiveな関連を有しているかもしれない






0 件のコメント:
コメントを投稿